Pb + AgNO3: Phản Ứng Hóa Học Đầy Thú Vị


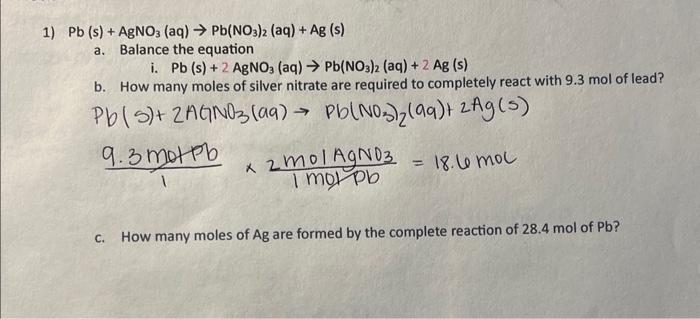
Chính Sách Vận Chuyển Và Đổi Trả Hàng
Miễn phí vận chuyển mọi đơn hàng từ 500K
- Phí ship mặc trong nước 50K
- Thời gian nhận hàng 2-3 ngày trong tuần
- Giao hàng hỏa tốc trong 24h
- Hoàn trả hàng trong 30 ngày nếu không hài lòng
Mô tả sản phẩm
Chủ đề Pb + AgNO3: Khám phá phản ứng giữa Pb và AgNO3, một trong những phản ứng hóa học phổ biến và thú vị. Tìm hiểu cách cân bằng phương trình, cơ chế phản ứng và những ứng dụng thực tiễn của nó trong đời sống và công nghiệp.
Phản ứng giữa chì (Pb) và bạc nitrat (AgNO3) là một phản ứng hóa học phổ biến trong hóa học vô cơ. Phản ứng này thường được sử dụng để minh họa các khái niệm về phản ứng oxi hóa - khử và cân bằng phương trình hóa học.
Phương trình phản ứng
Phương trình tổng quát của phản ứng này được viết như sau:
\[ \text{Pb} + 2\text{AgNO}_3 \rightarrow \text{Pb(NO}_3\text{)}_2 + 2\text{Ag} \]
Phản ứng chi tiết
Phản ứng có thể được chia thành các bước như sau:
- Chì (Pb) phản ứng với ion bạc nitrat (AgNO3) để tạo thành chì nitrat (Pb(NO3)2) và bạc (Ag).
- Ion bạc (Ag+) được khử thành bạc kim loại (Ag).
- Chì (Pb) bị oxi hóa thành ion chì (Pb2+).
Cân bằng phương trình
Để cân bằng phương trình phản ứng, chúng ta cần đảm bảo rằng số lượng nguyên tử của mỗi nguyên tố ở cả hai bên của phương trình phải bằng nhau. Phương trình cân bằng của phản ứng là:
\[ \text{Pb} + 2\text{AgNO}_3 \rightarrow \text{Pb(NO}_3\text{)}_2 + 2\text{Ag} \]
Ý nghĩa và ứng dụng
- Phản ứng này minh họa quá trình oxi hóa - khử, trong đó Pb bị oxi hóa và Ag bị khử.
- Phản ứng này được sử dụng trong việc tách bạc từ các hợp chất của nó.
- Đây là một phản ứng quan trọng trong các thí nghiệm hóa học và trong ngành công nghiệp khai khoáng.
Bảng tóm tắt phản ứng
| Phản ứng | Pb + 2AgNO3 → Pb(NO3)2 + 2Ag |
| Chất phản ứng | Chì (Pb), Bạc nitrat (AgNO3) |
| Sản phẩm | Chì nitrat (Pb(NO3)2), Bạc (Ag) |
| Loại phản ứng | Phản ứng oxi hóa - khử |
Chú ý an toàn
Khi thực hiện phản ứng này trong phòng thí nghiệm, cần chú ý các biện pháp an toàn sau:
- Đeo kính bảo hộ và găng tay bảo vệ.
- Thực hiện phản ứng trong khu vực thông thoáng hoặc dưới tủ hút khí.
- Tránh tiếp xúc trực tiếp với các hóa chất.
3" style="object-fit:cover; margin-right: 20px;" width="760px" height="428">
Tổng quan về phản ứng Pb + AgNO3
Phản ứng giữa chì (Pb) và bạc nitrat (AgNO3) là một phản ứng hóa học thú vị với nhiều ứng dụng trong thực tế. Dưới đây là tổng quan chi tiết về phản ứng này.
- Phương trình hóa học:
Pb + 2AgNO3 → Pb(NO3)2 + 2Ag
- Quá trình oxi hóa và khử:
Trong phản ứng này, chì (Pb) bị oxi hóa và bạc (Ag) bị khử. Quá trình có thể được biểu diễn như sau:
- Chì bị oxi hóa: Pb → Pb2+ + 2e-
- Bạc bị khử: 2Ag+ + 2e- → 2Ag
- Điều kiện phản ứng:
Phản ứng này thường diễn ra trong dung dịch nước và không yêu cầu điều kiện đặc biệt.
- Ứng dụng thực tế:
- Sản xuất bạc từ bạc nitrat trong công nghiệp.
- Thí nghiệm giáo dục để minh họa quá trình oxi hóa khử.
- Kết quả phản ứng:
Sau phản ứng, ta thu được chì nitrat (Pb(NO3)2) và bạc kim loại (Ag).
Chi tiết từng phần của phản ứng
Phản ứng giữa Pb và AgNO3 là một ví dụ điển hình của phản ứng thế đơn. Đây là một quá trình hóa học trong đó một kim loại mạnh hơn đẩy một kim loại yếu hơn ra khỏi dung dịch muối của nó.
- Phương trình tổng quát:
\[\ce{Pb + 2AgNO3 → 2Ag + Pb(NO3)2}\]
- Giải thích từng bước:
- Pb (chì) phản ứng với dung dịch AgNO3 (bạc nitrat).
- Chì (Pb) đẩy bạc (Ag) ra khỏi dung dịch bạc nitrat do tính hoạt động hóa học của chì cao hơn bạc.
- Kết quả là bạc (Ag) được tạo ra dưới dạng kim loại và chì nitrat (Pb(NO3)2) được hòa tan trong dung dịch.
- Phương trình ion rút gọn:
\[\ce{Pb(s) + 2Ag^+(aq) → 2Ag(s) + Pb^2+(aq)}\]
- Bảng mô tả các sản phẩm:
Chất phản ứng Sản phẩm Pb Pb(NO3)2 AgNO3 Ag
Các yếu tố ảnh hưởng đến phản ứng
Phản ứng giữa chì (Pb) và bạc nitrat (AgNO3) chịu ảnh hưởng bởi nhiều yếu tố khác nhau. Hiểu rõ các yếu tố này giúp tối ưu hóa quá trình phản ứng và đạt được kết quả mong muốn. Dưới đây là các yếu tố chính ảnh hưởng đến phản ứng này:
- Nhiệt độ:
Nhiệt độ của môi trường phản ứng có tác động lớn đến tốc độ phản ứng. Khi nhiệt độ tăng, các phân tử chuyển động nhanh hơn, làm tăng khả năng va chạm và phản ứng xảy ra nhanh hơn. Ngược lại, nhiệt độ thấp sẽ làm chậm quá trình phản ứng.
- Nồng độ các chất phản ứng:
Nồng độ của Pb và AgNO3 cũng ảnh hưởng trực tiếp đến tốc độ phản ứng. Nồng độ cao của các chất phản ứng làm tăng khả năng va chạm giữa các phân tử, do đó tăng tốc độ phản ứng.
- Diện tích bề mặt:
Diện tích bề mặt của chì trong phản ứng cũng là một yếu tố quan trọng. Diện tích bề mặt lớn hơn tạo điều kiện cho nhiều phân tử Pb và AgNO3 tiếp xúc và phản ứng với nhau, tăng tốc độ phản ứng.
- Sự hiện diện của chất xúc tác:
Chất xúc tác là những chất có khả năng tăng tốc độ phản ứng mà không bị tiêu thụ trong quá trình phản ứng. Sự hiện diện của chất xúc tác phù hợp có thể làm giảm năng lượng hoạt hóa và tăng tốc độ phản ứng giữa Pb và AgNO3.
- Tính chất hóa học của các chất phản ứng:
Các đặc điểm hóa học như tính oxi hóa và tính khử của Pb và AgNO3 cũng ảnh hưởng đến khả năng và tốc độ phản ứng. Các tính chất này quyết định mức độ phản ứng giữa hai chất.
- Trạng thái vật lý của các chất phản ứng:
Trạng thái rắn, lỏng hoặc khí của Pb và AgNO3 ảnh hưởng đến cách thức và tốc độ phản ứng. Thường thì các phản ứng xảy ra nhanh hơn khi các chất phản ứng ở dạng lỏng hoặc khí so với trạng thái rắn.
Kết luận
Phản ứng giữa chì (Pb) và bạc nitrat (AgNO3) là một phản ứng oxi hóa - khử đặc trưng. Phản ứng này diễn ra như sau:
\[
\text{Pb} + 2\text{AgNO}_3 \rightarrow \text{Pb(NO}_3\text{)}_2 + 2\text{Ag}
\]
Qua phản ứng này, ta thấy:
- Chì (Pb) bị oxi hóa từ trạng thái oxi hóa 0 lên +2 trong hợp chất \(\text{Pb(NO}_3\text{)}_2\).
- Bạc (Ag) trong bạc nitrat bị khử từ trạng thái oxi hóa +1 xuống 0 và kết tủa dưới dạng kim loại bạc.
Phản ứng này được điều khiển bởi các yếu tố sau:
- Nồng độ chất phản ứng: Nồng độ của AgNO3 càng cao thì phản ứng diễn ra càng nhanh và mạnh.
- Nhiệt độ: Nhiệt độ cao có thể tăng tốc độ phản ứng, nhưng cũng cần chú ý tránh nhiệt độ quá cao gây phân hủy các chất tham gia phản ứng.
- Diện tích bề mặt: Diện tích bề mặt của chì càng lớn thì phản ứng diễn ra càng nhanh do diện tích tiếp xúc tăng.
- Chất xúc tác: Một số chất xúc tác có thể làm tăng tốc độ phản ứng, tuy nhiên trong phản ứng này, chất xúc tác thường không cần thiết.
Kết quả cuối cùng của phản ứng là sự tạo thành chì nitrat và bạc kim loại. Phản ứng này không chỉ minh họa cho quá trình oxi hóa - khử mà còn thể hiện rõ nguyên tắc bảo toàn khối lượng, nơi mà số lượng nguyên tử của mỗi nguyên tố được bảo toàn trước và sau phản ứng.