Phản ứng giữa Sắt (Fe) và Đồng(II) Sulfat (CuSO<sub>4</sub>): Một Phân Tích Chi Tiết

Chính Sách Vận Chuyển Và Đổi Trả Hàng
Miễn phí vận chuyển mọi đơn hàng từ 500K
- Phí ship mặc trong nước 50K
- Thời gian nhận hàng 2-3 ngày trong tuần
- Giao hàng hỏa tốc trong 24h
- Hoàn trả hàng trong 30 ngày nếu không hài lòng
Mô tả sản phẩm
Phản ứng giữa kim loại Sắt (Fe) và dung dịch Đồng(II) Sulfat (CuSO4) là một ví dụ điển hình và kinh điển trong hóa học về phản ứng thế đơn (phản ứng thế kim loại mạnh đẩy kim loại yếu hơn ra khỏi muối của nó). Đây cũng là một phản ứng oxi hóa – khử. Phản ứng này được ứng dụng rộng rãi trong giảng dạy hóa học và có vai trò quan trọng trong các quá trình công nghiệp như chiết tách kim loại và xử lý nước thải.
1. Phương Trình Hóa Học:
Phản ứng giữa Sắt và Đồng(II) Sulfat diễn ra theo phương trình sau:
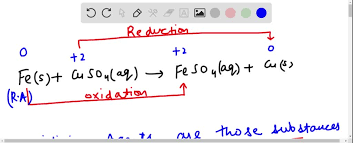
Fe (r) + CuSO4 (dd) → FeSO4 (dd) + Cu (r)
Trong đó:
- Fe (r): Sắt kim loại ở dạng rắn.
- CuSO4 (dd): Đồng(II) Sulfat ở dạng dung dịch (dung dịch nước).
- FeSO4 (dd): Sắt(II) Sulfat ở dạng dung dịch (dung dịch nước).
- Cu (r): Đồng kim loại ở dạng rắn.
2. Giải Thích Cơ Chế Phản Ứng:
Phản ứng này xảy ra vì Sắt là một kim loại hoạt động hóa học mạnh hơn Đồng. Trong dãy hoạt động hóa học (dãy điện hóa), Sắt đứng trước Đồng, điều này có nghĩa là Sắt có khả năng nhường electron tốt hơn Đồng, hay Sắt có tính khử mạnh hơn.
Cụ thể, trong phản ứng này:
- Quá trình oxi hóa (Fe bị oxi hóa): Nguyên tử Sắt (Fe0) nhường 2 electron để tạo thành ion Sắt(II) (Fe2+), hòa tan vào dung dịch.
Fe0 → Fe2+ + 2e- - Quá trình khử (Cu2+ bị khử): Ion Đồng(II) (Cu2+) từ dung dịch CuSO4 nhận 2 electron do Sắt nhường ra, trở thành nguyên tử Đồng (Cu0) và bám vào bề mặt miếng Sắt hoặc lắng xuống.
Cu2+ + 2e- → Cu0
Fe (r) + Cu2+ (dd) → Fe2+ (dd) + Cu (r)
3. Hiện Tượng Quan Sát Được:
Khi cho một miếng Sắt (ví dụ: đinh Sắt, dây Sắt) vào dung dịch Đồng(II) Sulfat:
- Màu sắc dung dịch thay đổi: Dung dịch Đồng(II) Sulfat ban đầu có màu xanh lam đặc trưng (do ion Cu2+). Khi phản ứng xảy ra, ion Cu2+ dần chuyển thành Cu0, và ion Fe2+ (có màu xanh lục nhạt) được tạo thành. Do đó, màu xanh lam của dung dịch dần nhạt đi và chuyển sang màu xanh lục nhạt.
- Xuất hiện chất rắn màu đỏ: Một lớp chất rắn màu đỏ nâu (là kim loại Đồng) sẽ bám dần lên bề mặt của miếng Sắt.
- Miếng Sắt bị ăn mòn: Khối lượng miếng Sắt sẽ giảm đi do một phần Sắt đã tan vào dung dịch dưới dạng ion Fe2+. Tuy nhiên, khối lượng tổng thể của miếng Sắt có thể tăng lên nếu khối lượng Đồng bám vào lớn hơn khối lượng Sắt bị ăn mòn (do khối lượng mol của Cu (63.5 g/mol) lớn hơn của Fe (55.8 g/mol)).
4. Ứng Dụng và Ý Nghĩa:
- Trong giáo dục: Phản ứng này là một thí nghiệm cổ điển để minh họa về phản ứng thế, dãy hoạt động hóa học, phản ứng oxi hóa – khử, và sự thay đổi màu sắc của dung dịch trong hóa học vô cơ.
- Mạ điện và xi mạ: Mặc dù không phải là phương pháp chính, nguyên lý của phản ứng này có thể được liên hệ với quá trình mạ điện, nơi một kim loại được phủ lên bề mặt của kim loại khác.
- Xử lý nước thải: Trong một số trường hợp, Fe có thể được sử dụng để loại bỏ các ion kim loại nặng (như Cu2+) từ nước thải thông qua phản ứng kết tủa hoặc thế.
- Ăn mòn kim loại: Phản ứng này cũng minh họa nguyên lý cơ bản của ăn mòn điện hóa, nơi một kim loại hoạt động hơn bị ăn mòn khi tiếp xúc với dung dịch chứa ion của kim loại kém hoạt động hơn.
5. Các Yếu Tố Ảnh Hưởng Đến Tốc Độ Phản Ứng:
Tốc độ của phản ứng này có thể bị ảnh hưởng bởi một số yếu tố:
- Nhiệt độ: Tăng nhiệt độ thường làm tăng tốc độ phản ứng.
- Nồng độ CuSO4: Nồng độ CuSO4 càng cao, tốc độ phản ứng càng nhanh.
- Diện tích bề mặt tiếp xúc của Fe: Sắt dạng bột hoặc vụn sẽ phản ứng nhanh hơn Sắt dạng khối vì có diện tích bề mặt lớn hơn.
- Khuấy trộn: Khuấy trộn dung dịch có thể giúp tăng tốc độ phản ứng bằng cách đưa ion Cu2+ mới đến bề mặt Sắt.
6. An Toàn:
Mặc dù phản ứng này tương đối an toàn để thực hiện trong phòng thí nghiệm, cần lưu ý:
- Đồng(II) Sulfat là chất độc nếu nuốt phải và có thể gây kích ứng da, mắt. Cần đeo kính bảo hộ và găng tay khi làm việc với hóa chất này.
- Sau khi thí nghiệm, các dung dịch chứa ion kim loại (Fe2+, Cu2+ dư) và chất rắn kim loại Đồng cần được xử lý theo quy định về chất thải hóa học để tránh gây ô nhiễm môi trường.
Tóm lại, phản ứng giữa Sắt và Đồng(II) Sulfat là một ví dụ minh họa tuyệt vời cho nhiều khái niệm hóa học cơ bản, từ phản ứng thế đến quá trình oxi hóa – khử, và có ý nghĩa thực tiễn trong cả lĩnh vực giáo dục lẫn công nghiệp."