Phản ứng của Sắt(II,III) Oxit (Fe3O4) với Axit Sulfuric (H2SO4)

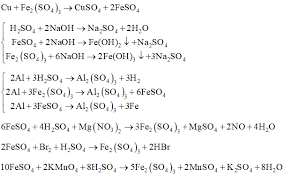
Chính Sách Vận Chuyển Và Đổi Trả Hàng
Miễn phí vận chuyển mọi đơn hàng từ 500K
- Phí ship mặc trong nước 50K
- Thời gian nhận hàng 2-3 ngày trong tuần
- Giao hàng hỏa tốc trong 24h
- Hoàn trả hàng trong 30 ngày nếu không hài lòng
Mô tả sản phẩm
Sắt(II,III) oxit, thường được biết đến với tên gọi oxit sắt từ hoặc magnetite, có công thức hóa học là Fe3O4. Đây là một hợp chất oxit phức tạp của sắt, thường được coi là một oxit hỗn hợp của sắt(II) oxit (FeO) và sắt(III) oxit (Fe2O3) với công thức dạng FeO·Fe2O3. Axit sulfuric (H2SO4) là một trong những axit mạnh nhất và là một hóa chất công nghiệp cực kỳ quan trọng, có khả năng thể hiện các tính chất khác nhau tùy thuộc vào nồng độ và nhiệt độ. Sự tương tác giữa Fe3O4 và H2SO4 là một ví dụ điển hình cho thấy tính chất hóa học của Fe3O4 bị ảnh hưởng bởi nồng độ và điều kiện của axit.
1. Phản ứng với Axit Sulfuric loãng (H2SO4 loãng):
Khi Fe3O4 phản ứng với axit sulfuric loãng, H2SO4 hoạt động như một axit thông thường. Vì Fe3O4 có thể được coi là sự kết hợp của FeO và Fe2O3, cả hai thành phần này đều sẽ phản ứng với axit loãng để tạo ra muối tương ứng. Đây là một phản ứng axit-bazơ thông thường, không có sự thay đổi số oxi hóa của sắt.
Phương trình hóa học:
Fe3O4(r) + 4H2SO4(dd loãng) → FeSO4(dd) + Fe2(SO4)3(dd) + 4H2O(l)
Giải thích:
Trong phản ứng này, thành phần FeO của Fe3O4 sẽ phản ứng với H2SO4 tạo ra sắt(II) sulfat (FeSO4): FeO + H2SO4 → FeSO4 + H2O.
Thành phần Fe2O3 của Fe3O4 sẽ phản ứng với H2SO4 tạo ra sắt(III) sulfat (Fe2(SO4)3): Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O.
Do đó, sản phẩm cuối cùng là hỗn hợp của hai loại muối sulfat của sắt: sắt(II) sulfat (có màu xanh lục nhạt trong dung dịch) và sắt(III) sulfat (có màu vàng nâu trong dung dịch). Dung dịch thu được sẽ có màu tổng hợp của cả hai ion Fe2+ và Fe3+.
2. Phản ứng với Axit Sulfuric đặc, nóng (H2SO4 đặc, nóng):
Khi Fe3O4 phản ứng với axit sulfuric đặc và nóng, H2SO4 không chỉ hoạt động như một axit mà còn thể hiện tính oxi hóa mạnh. Trong trường hợp này, sắt(II) trong Fe3O4 (dạng FeO) sẽ bị oxi hóa thành sắt(III), và ion sulfat (SO42-) trong H2SO4 sẽ bị khử.
Phương trình hóa học:
2Fe3O4(r) + 10H2SO4(dd đặc, nóng) → 3Fe2(SO4)3(dd) + SO2(k)↑ + 10H2O(l)
Giải thích:
Trong phản ứng này, số oxi hóa của sắt trong Fe3O4 (trung bình là +8/3, với sự hiện diện của Fe2+ và Fe3+) sẽ tăng lên thành +3 trong Fe2(SO4)3. Cụ thể, các ion Fe2+ trong Fe3O4 sẽ bị H2SO4 đặc, nóng oxi hóa thành Fe3+.
Đồng thời, lưu huỳnh trong H2SO4 từ số oxi hóa +6 bị khử xuống số oxi hóa +4, tạo thành khí lưu huỳnh đioxit (SO2), một loại khí không màu, có mùi hắc đặc trưng và gây khó chịu.
Sản phẩm cuối cùng là sắt(III) sulfat (Fe2(SO4)3), khí lưu huỳnh đioxit (SO2) và nước. Dung dịch muối thu được sẽ chỉ có ion Fe3+, do đó sẽ có màu vàng nâu đặc trưng.
Tổng kết và Lưu ý:
Sự khác biệt cơ bản trong sản phẩm giữa hai phản ứng này nằm ở tính oxi hóa của H2SO4. Với H2SO4 loãng, không có sự thay đổi số oxi hóa của sắt; trong khi với H2SO4 đặc, nóng, sắt(II) trong Fe3O4 bị oxi hóa hoàn toàn thành sắt(III), đồng thời giải phóng khí SO2.
Những phản ứng này có ý nghĩa quan trọng trong hóa học vô cơ, đặc biệt là trong các quá trình xử lý quặng sắt hoặc sản xuất các hợp chất sắt khác nhau. Khi tiến hành các phản ứng với H2SO4, đặc biệt là H2SO4 đặc, cần hết sức cẩn thận do tính ăn mòn mạnh và khả năng tỏa nhiệt cao của axit này.