Phản ứng của Fe3O4 với HI: Một Phân Tích Chi Tiết

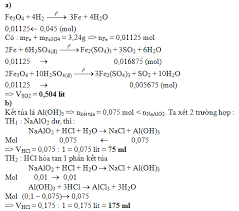

Chính Sách Vận Chuyển Và Đổi Trả Hàng
Miễn phí vận chuyển mọi đơn hàng từ 500K
- Phí ship mặc trong nước 50K
- Thời gian nhận hàng 2-3 ngày trong tuần
- Giao hàng hỏa tốc trong 24h
- Hoàn trả hàng trong 30 ngày nếu không hài lòng
Mô tả sản phẩm
Phản ứng giữa oxit sắt từ (Fe3O4) và axit hydriodic (HI) là một ví dụ điển hình về sự kết hợp giữa phản ứng axit-bazơ và phản ứng oxy hóa-khử, thể hiện rõ ràng tính chất đặc biệt của các hợp chất tham gia. Để hiểu rõ phản ứng này, chúng ta cần xem xét tính chất của từng chất phản ứng. Fe3O4, còn được gọi là magnetit, là một oxit hỗn hợp của sắt, có công thức FeO·Fe2O3 hoặc viết gọn là Fe3O4. Điều này có nghĩa là trong cấu trúc của nó, sắt tồn tại ở cả trạng thái oxy hóa +2 (Fe(II)) và +3 (Fe(III)). Về tính chất hóa học, Fe3O4 là một oxit bazơ nhưng cũng thể hiện một phần tính lưỡng tính yếu khi phản ứng với các axit mạnh. Mặt khác, HI (axit hydriodic) là một trong những axit mạnh nhất và đồng thời là một chất khử rất mạnh. Khả năng khử mạnh của HI đến từ ion iodua (I-), vốn có xu hướng rất lớn bị oxy hóa thành iod (I2) do kích thước lớn và độ âm điện thấp, khiến electron ngoài cùng dễ dàng bị tách ra. Khi Fe3O4 tiếp xúc với dung dịch HI, ban đầu sẽ xảy ra phản ứng axit-bazơ thông thường. Fe3O4 sẽ phản ứng với HI để tạo ra các muối iodua của sắt(II) và sắt(III), cùng với nước. Phương trình sơ bộ có thể hình dung là: Fe3O4 + 8HI → FeI2 + 2FeI3 + 4H2O. Tuy nhiên, đây chưa phải là sản phẩm cuối cùng. Ngay sau khi FeI3 (sắt(III) iodua) được tạo thành, ion Fe(III) trong FeI3 đóng vai trò là một chất oxy hóa. Do HI là một chất khử cực mạnh, ion iodua (I-) sẽ ngay lập tức phản ứng với ion sắt(III) để khử Fe(III) thành Fe(II), đồng thời bản thân I- bị oxy hóa thành iod tự do (I2). Phản ứng oxy hóa-khử này có thể được viết như sau: 2Fe(III) + 2I- → 2Fe(II) + I2. Kết hợp cả hai quá trình trên, phản ứng tổng thể và cân bằng giữa Fe3O4 và HI là: Fe3O4 + 8HI → 3FeI2 + I2 + 4H2O. Trong phản ứng này, tất cả sắt ban đầu ở trạng thái oxy hóa +3 (từ Fe2O3 trong Fe3O4) đều được khử xuống trạng thái +2 (tạo thành FeI2), trong khi đó ion iodua (I-) bị oxy hóa thành iod phân tử (I2). Quan sát hiện tượng, dung dịch sau phản ứng sẽ chuyển sang màu xanh lục đặc trưng của muối sắt(II) iodua (FeI2) và đồng thời xuất hiện màu nâu vàng hoặc nâu đỏ của iod tự do (I2) hòa tan trong dung dịch. Phản ứng này là một minh chứng rõ nét cho tính chất khử mạnh của HI và khả năng chuyển đổi trạng thái oxy hóa của sắt trong các hợp chất. Nó cũng quan trọng trong việc nghiên cứu hóa học vô cơ, đặc biệt là trong việc điều chế các hợp chất sắt(II) từ các oxit sắt có chứa Fe(III) khi sử dụng các axit có tính khử. Về mặt ứng dụng, phản ứng này không thường được sử dụng trong công nghiệp ở quy mô lớn, nhưng nó có giá trị trong nghiên cứu và phòng thí nghiệm để điều chế iod và các hợp chất sắt(II) nhất định. Do HI là một axit mạnh và ăn mòn, cùng với việc I2 là một chất có độc tính, các biện pháp an toàn cần được tuân thủ nghiêm ngặt khi thực hiện phản ứng này trong phòng thí nghiệm.