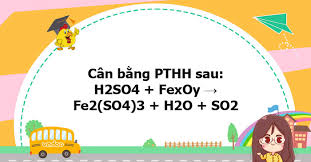
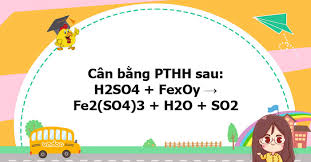
Phản ứng của Oxit Sắt (fexoy) với Axit Sulfuric (H2SO4)

Chính Sách Vận Chuyển Và Đổi Trả Hàng
Miễn phí vận chuyển mọi đơn hàng từ 500K
- Phí ship mặc trong nước 50K
- Thời gian nhận hàng 2-3 ngày trong tuần
- Giao hàng hỏa tốc trong 24h
- Hoàn trả hàng trong 30 ngày nếu không hài lòng
Mô tả sản phẩm
Trong hóa học, "fexoy" thường được sử dụng như một ký hiệu chung để chỉ các oxit của sắt, bao gồm Sắt(II) oxit (FeO), Sắt(III) oxit (Fe2O3), và Sắt từ oxit (Fe3O4). Mỗi loại oxit này có tính chất và phản ứng riêng biệt với axit sulfuric (H2SO4), tùy thuộc vào nồng độ và nhiệt độ của axit. Dưới đây là phân tích chi tiết về các phản ứng này. 1. Phản ứng với Axit Sulfuric loãng (H2SO4 loãng) Khi phản ứng với H2SO4 loãng, các oxit sắt thể hiện tính chất oxit bazơ, tạo thành muối sulfat và nước. Đây là các phản ứng trao đổi thông thường, không có sự thay đổi số oxi hóa của sắt.
- Sắt(II) oxit (FeO): FeO là một oxit bazơ. Khi tác dụng với H2SO4 loãng, nó tạo ra muối Sắt(II) sulfat (FeSO4) và nước.
FeO(r) + H2SO4(dd loãng) → FeSO4(dd) + H2O(l)
Dung dịch FeSO4 có màu lục nhạt đặc trưng. - Sắt(III) oxit (Fe2O3): Fe2O3 cũng là một oxit bazơ. Khi tác dụng với H2SO4 loãng, nó tạo ra muối Sắt(III) sulfat (Fe2(SO4)3) và nước.
Fe2O3(r) + 3H2SO4(dd loãng) → Fe2(SO4)3(dd) + 3H2O(l)
Dung dịch Fe2(SO4)3 có màu vàng nâu. - Sắt từ oxit (Fe3O4): Fe3O4 có thể coi là hỗn hợp của FeO và Fe2O3 (FeO·Fe2O3). Do đó, khi tác dụng với H2SO4 loãng, nó sẽ tạo ra cả muối Sắt(II) sulfat và Sắt(III) sulfat cùng với nước.
Fe3O4(r) + 4H2SO4(dd loãng) → FeSO4(dd) + Fe2(SO4)3(dd) + 4H2O(l)
Dung dịch thu được sẽ có màu đặc trưng của cả ion Fe2+ (lục nhạt) và Fe3+ (vàng nâu).
- Sắt(II) oxit (FeO): Khi FeO phản ứng với H2SO4 đặc, nóng, sắt(II) (số oxi hóa +2) có thể bị oxi hóa lên sắt(III) (số oxi hóa +3) bởi H2SO4. Đồng thời, H2SO4 bị khử xuống các sản phẩm có số oxi hóa thấp hơn, phổ biến là khí SO2.
2FeO(r) + 4H2SO4(dd đặc, nóng) → Fe2(SO4)3(dd) + SO2(k) + 4H2O(l)
Dung dịch thu được sẽ có màu vàng nâu của Fe2(SO4)3 và có khí SO2 (mùi hắc) thoát ra. - Sắt(III) oxit (Fe2O3): Sắt trong Fe2O3 đã ở số oxi hóa cao nhất là +3, nên không thể bị oxi hóa thêm bởi H2SO4 đặc, nóng. Phản ứng với H2SO4 đặc, nóng vẫn là phản ứng axit-bazơ thông thường, tương tự như với H2SO4 loãng, nhưng có thể diễn ra nhanh hơn và cần nhiệt độ.
Fe2O3(r) + 3H2SO4(dd đặc, nóng) → Fe2(SO4)3(dd) + 3H2O(l)
Dung dịch thu được có màu vàng nâu của Fe2(SO4)3. - Sắt từ oxit (Fe3O4): Fe3O4 chứa cả Fe(II) và Fe(III). Mặc dù H2SO4 đặc, nóng có tính oxi hóa, phản ứng chính vẫn là tạo ra cả muối Fe(II) và Fe(III). Tuy nhiên, trong điều kiện rất khắc nghiệt (nhiệt độ rất cao hoặc nồng độ H2SO4 cực lớn), một phần Fe(II) có thể bị oxi hóa thành Fe(III), làm cho sản phẩm cuối cùng chủ yếu là Fe2(SO4)3.
Phản ứng chính (axit-bazơ):Fe3O4(r) + 4H2SO4(dd đặc, nóng) → FeSO4(dd) + Fe2(SO4)3(dd) + 4H2O(l)
Phản ứng phụ (oxi hóa-khử, thường ít xảy ra hoặc cần điều kiện khắc nghiệt để toàn bộ Fe(II) chuyển hóa):2Fe3O4(r) + 10H2SO4(dd đặc, nóng) → 3Fe2(SO4)3(dd) + SO2(k) + 10H2O(l)
Trong thực tế, phản ứng chính là tạo ra hỗn hợp FeSO4 và Fe2(SO4)3.