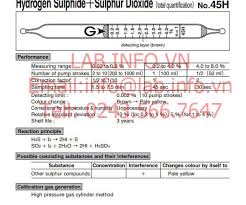
Tìm hiểu chi tiết về Hydrogen Sulfide (H2S) và Sulfur Dioxide (SO2)

Chính Sách Vận Chuyển Và Đổi Trả Hàng
Miễn phí vận chuyển mọi đơn hàng từ 500K
- Phí ship mặc trong nước 50K
- Thời gian nhận hàng 2-3 ngày trong tuần
- Giao hàng hỏa tốc trong 24h
- Hoàn trả hàng trong 30 ngày nếu không hài lòng
Mô tả sản phẩm
Hydrogen Sulfide (H2S) và Sulfur Dioxide (SO2) là hai hợp chất quan trọng của lưu huỳnh, thường xuất hiện cùng nhau trong nhiều quá trình tự nhiên và công nghiệp. Cả hai đều có những đặc tính hóa học và vật lý riêng biệt, đồng thời gây ra những tác động đáng kể đến môi trường và sức khỏe con người. Bài viết này sẽ đi sâu vào phân tích từng hợp chất, từ tính chất, nguồn gốc, ứng dụng đến những ảnh hưởng và biện pháp kiểm soát chúng.
I. Hydrogen Sulfide (H2S) – Khí Hắc Ít Thôi
Hydrogen Sulfide, hay còn gọi là Hydro sulfua, là một chất khí không màu, dễ cháy, có mùi trứng thối đặc trưng ở nồng độ thấp. Tuy nhiên, ở nồng độ cao, nó có thể gây tê liệt khứu giác, khiến người tiếp xúc không còn nhận ra mùi nguy hiểm của nó.
1. Tính chất vật lý:
- Là khí không màu.
- Có mùi trứng thối đặc trưng (ở nồng độ thấp).
- Nặng hơn không khí (khối lượng mol 34 g/mol so với không khí khoảng 29 g/mol).
- Tan ít trong nước, tạo thành dung dịch axit hydrosulfuric yếu.
- Điểm sôi: -60°C; Điểm nóng chảy: -85.7°C.
- Rất độc.
- Là một axit yếu (axit hydrosulfuric), có thể tác dụng với bazơ và oxit bazơ tạo muối sulfide. Ví dụ: H2S + 2NaOH → Na2S + 2H2O.
- Là một chất khử mạnh: Lưu huỳnh trong H2S có số oxi hóa -2, dễ dàng bị oxi hóa lên các trạng thái cao hơn (0 trong S, +4 trong SO2, +6 trong SO3/H2SO4).
- Cháy trong không khí: 2H2S + 3O2 → 2SO2 + 2H2O (nếu đủ oxi).
- Oxi hóa không hoàn toàn: 2H2S + O2 → 2S + 2H2O (nếu thiếu oxi).
- Tác dụng với halogen: H2S + Cl2 → S + 2HCl.
- Tác dụng với dung dịch muối của kim loại nặng tạo kết tủa sulfide không tan: H2S + CuCl2 → CuS↓ + 2HCl (CuS là chất rắn màu đen).
- Tự nhiên:
- Sản phẩm của quá trình phân hủy kị khí chất hữu cơ bởi vi khuẩn (trong đầm lầy, cống rãnh, bùn đáy ao hồ, hệ thống xử lý nước thải).
- Khí núi lửa và suối nước nóng.
- Phân hủy vật chất hữu cơ giàu protein.
- Công nghiệp:
- Khai thác và chế biến dầu khí, lọc hóa dầu (khí chua).
- Sản xuất giấy bằng phương pháp Kraft.
- Sản xuất hóa chất, thuộc da, dệt may.
- Xử lý nước thải công nghiệp và đô thị.
- H2S ít có ứng dụng trực tiếp do độc tính cao.
- Đôi khi được dùng làm chất trung gian trong tổng hợp hóa học, hoặc để sản xuất lưu huỳnh elemental (quá trình Claus).
- Trong phân tích hóa học, dùng để nhận biết một số ion kim loại nặng qua kết tủa sulfide.
- Môi trường: Gây mùi hôi khó chịu, ăn mòn kim loại, phá hủy đường ống, thiết bị. Khi bị oxi hóa trong khí quyển, H2S có thể chuyển hóa thành SO2, góp phần gây mưa axit.
- Sức khỏe: H2S là chất cực độc, tác động lên hệ thần kinh trung ương và hô hấp.
- Nồng độ thấp (0.1 - 10 ppm): Kích ứng mắt, mũi, họng, đau đầu, buồn nôn.
- Nồng độ trung bình (50 - 200 ppm): Viêm phế quản, phù phổi, mất khứu giác, chóng mặt, buồn nôn.
- Nồng độ cao (>500 ppm): Mất ý thức đột ngột, co giật, suy hô hấp, ngưng tim và tử vong nhanh chóng (thậm chí chỉ sau vài hơi thở ở nồng độ trên 1000 ppm).
II. Sulfur Dioxide (SO2) – Khí Độc Từ Đốt Cháy
Sulfur Dioxide, hay còn gọi là Lưu huỳnh đioxit, là một chất khí độc hại, không màu, có mùi hắc khó chịu, thường được biết đến là nguyên nhân chính gây ra mưa axit.
1. Tính chất vật lý:
- Là khí không màu.
- Có mùi hắc, sốc, khó chịu.
- Nặng hơn không khí (khối lượng mol 64 g/mol).
- Tan nhiều trong nước, tạo dung dịch axit sulfurơ yếu.
- Điểm sôi: -10°C; Điểm nóng chảy: -75.5°C.
- Là một oxit axit:
- Tác dụng với nước tạo axit sulfurơ yếu: SO2 + H2O ⇌ H2SO3.
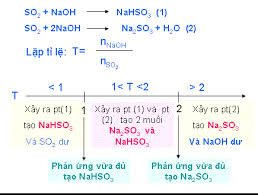
- Tác dụng với dung dịch bazơ tạo muối sulfite và/hoặc bisulfite: SO2 + 2NaOH → Na2SO3 + H2O; SO2 + NaOH → NaHSO3.
- Tác dụng với oxit bazơ.
- Vừa là chất khử, vừa là chất oxi hóa (Lưu huỳnh trong SO2 có số oxi hóa +4):
- Tính khử (thường gặp hơn): Bị oxi hóa lên +6.
- Tác dụng với oxi (có xúc tác V2O5, t°): 2SO2 + O2 ⇌ 2SO3 (phản ứng quan trọng trong sản xuất H2SO4).
- Tác dụng với dung dịch nước Br2 (làm mất màu dung dịch): SO2 + Br2 + 2H2O → H2SO4 + 2HBr.
- Tác dụng với KMnO4 (làm mất màu dung dịch tím): 5SO2 + 2KMnO4 + 2H2O → K2SO4 + 2MnSO4 + 2H2SO4.
- Tính oxi hóa: Bị khử xuống 0 hoặc -2.
- Tác dụng với H2S: SO2 + 2H2S → 3S + 2H2O.
- Tác dụng với Mg (nung nóng): 3Mg + SO2 → 2MgO + MgS.
- Tính khử (thường gặp hơn): Bị oxi hóa lên +6.
- Có tính tẩy màu (tẩy trắng): Khử màu các chất hữu cơ như giấy, đường, sợi vải do khả năng kết hợp với các nhóm mang màu. Tuy nhiên, màu có thể phục hồi nếu để trong không khí.
- Tự nhiên:
- Phun trào núi lửa (là nguồn tự nhiên lớn nhất).
- Cháy rừng (khi cây cối chứa lưu huỳnh bị đốt).
- Nhân tạo (chủ yếu):
- Đốt nhiên liệu hóa thạch (than đá, dầu mỏ, khí đốt) chứa lưu huỳnh trong các nhà máy điện, công nghiệp, giao thông vận tải.
- Các quá trình luyện kim (luyện quặng sulfide như CuS, FeS2).
- Sản xuất axit sulfuric.
- Một số ngành công nghiệp hóa chất khác.
- Sản xuất axit sulfuric (H2SO4): Đây là ứng dụng quan trọng nhất của SO2.
- Chất tẩy trắng: Trong công nghiệp sản xuất giấy, dệt may, tẩy trắng đường.
- Chất bảo quản: Ngăn chặn sự phát triển của vi khuẩn và nấm mốc trong một số loại thực phẩm và đồ uống (ví dụ: rượu vang, hoa quả khô). Ký hiệu là E220.
- Chất khử trùng: Dùng để xông khói khử trùng kho tàng, hầm rượu.
- Môi trường:
- Mưa axit: SO2 tan trong nước mưa tạo H2SO3, sau đó H2SO3 có thể bị oxi hóa thành H2SO4. Mưa axit gây ăn mòn công trình, phá hủy rừng, suy thoái đất, và axit hóa nguồn nước.
- Ô nhiễm không khí: Gây sương mù quang hóa, giảm tầm nhìn.
- Hại thực vật: Gây tổn thương lá, giảm năng suất cây trồng.
- Sức khỏe: SO2 là chất gây kích ứng mạnh mẽ đường hô hấp.
- Gây viêm đường hô hấp, ho, khó thở, tức ngực.
- Đặc biệt nguy hiểm đối với những người mắc bệnh hen suyễn, viêm phế quản mãn tính, hoặc các bệnh về tim mạch.
- Phơi nhiễm lâu dài có thể gây tổn thương phổi vĩnh viễn.
III. Mối liên hệ và Biện pháp kiểm soát
H2S và SO2 có mối liên hệ mật thiết. H2S, khi phát thải vào khí quyển, có thể bị oxi hóa thành SO2, góp phần vào vấn đề ô nhiễm SO2 và mưa axit. Cả hai đều là những chất gây ô nhiễm không khí nguy hiểm, đòi hỏi các biện pháp kiểm soát nghiêm ngặt.
Biện pháp kiểm soát:
- Xử lý khí thải công nghiệp: Sử dụng các công nghệ lọc khí thải như khử lưu huỳnh khí thải (Flue Gas Desulfurization - FGD) cho SO2, hoặc hấp thụ, oxi hóa cho H2S.
- Sử dụng nhiên liệu sạch: Khuyến khích sử dụng nhiên liệu có hàm lượng lưu huỳnh thấp hoặc không lưu huỳnh (ví dụ: khí tự nhiên).
- Nâng cao hiệu quả đốt cháy: Giảm lượng nhiên liệu cần thiết và do đó giảm lượng khí thải.
- Chuyển đổi năng lượng: Phát triển và sử dụng các nguồn năng lượng tái tạo (mặt trời, gió) thay thế nhiên liệu hóa thạch.
- Giám sát và quy định: Thiết lập các tiêu chuẩn phát thải nghiêm ngặt và hệ thống giám sát chất lượng không khí để đảm bảo tuân thủ.
- Xử lý nước thải: Xử lý triệt để nước thải công nghiệp và sinh hoạt để ngăn chặn quá trình phân hủy kị khí tạo H2S.
Tóm lại, H2S và SO2 là những hợp chất lưu huỳnh có tác động sâu rộng đến môi trường và sức khỏe. Việc hiểu rõ tính chất, nguồn gốc và tác động của chúng là rất quan trọng để xây dựng các chiến lược hiệu quả nhằm giảm thiểu ô nhiễm, bảo vệ môi trường và cải thiện chất lượng cuộc sống.