Công thức Lewis của ClO3-
Công thức Lewis của ClO3- - Hướng dẫn cách viết công thức electron, công thức Lewis, công thức cấu tạo của các nguyên tố hóa học chương trình mới chi tiết.
Số oxi hóa của Mn trong MnO4- là:
Số oxi hóa của Mn trong MnO4- là:
Công thức tính hiệu suất phản ứng ester hóa (hay, chi tiết)
Công thức tính hiệu suất phản ứng ester hóa (hay, chi tiết) - Tóm tắt công thức Hóa học lớp 12 quan trọng đầy đủ, chi tiết giúp học sinh dễ dàng nhớ được công thức Hóa 12.
Ancol là gì? Tính chất, điều chế, ứng dụng của ancol
Ancol hay còn được gọi với cái tên quen thuộc là rượu. Ancol là gì? Công thức của ancol? cách gọi tên ancol? đặc điểm tính chất lý hóa ancol? Ứng dụng của ancol
Cu(OH)2 (Copper (II) hydroxide) (Tính chất hóa học, vật lí, nhận biết, điều chế, ứng dụng).
Cu(OH)2 (Copper (II) hydroxide) (Tính chất hóa học, vật lí, nhận biết, điều chế, ứng dụng) - Tổng hợp tính chất hóa học, tính chất vật lí, phản ứng hóa học, cách nhận biết, điều chế và ứng dụng của tất cả đơn chất, hợp chất hóa học.
Ca(OH)2 + H3PO4 → Ca(H2PO4)2 ↓ + H2O | Ca(OH)2 ra Ca(H2PO4)2 | H3PO4 ra Ca(H2PO4)2.
Ca(OH)2 + H3PO4 → Ca(H2PO4)2 ↓ + H2O | Ca(OH)2 ra Ca(H2PO4)2 | H3PO4 ra Ca(H2PO4)2 - Hướng dẫn cân bằng phản ứng hóa học của tất cả phương trình hóa học thường gặp giúp bạn học tốt môn Hóa.
H2SiO3 + NaOH: Phản ứng hóa học và ứng dụng thực tiễn
Chủ đề h2sio3+naoh Phản ứng giữa H2SiO3 và NaOH là một quá trình hóa học quan trọng, được ứng dụng rộng rãi trong nhiều lĩnh vực công nghiệp như sản xuất thủy tinh, gốm sứ, và chất tẩy rửa. Trong bài viết này, chúng ta sẽ khám phá chi tiết phương trình hóa học, các điều kiện phản ứng, và những ứng dụng nổi bật mà phản ứng này mang lại.
Al2(SO4)3 (Aluminium sulfate) (Tính chất hóa học, vật lí, nhận biết, điều chế, ứng dụng).
Al2(SO4)3 (Aluminium sulfate) (Tính chất hóa học, vật lí, nhận biết, điều chế, ứng dụng) - Tổng hợp tính chất hóa học, tính chất vật lí, phản ứng hóa học, cách nhận biết, điều chế và ứng dụng của tất cả đơn chất, hợp chất hóa học.
Cho phản ứng hóa học: CH3COOH + C2H5OH H2SO4 đặc nhiệt độ CH3COOC2H5 + H2O (Miễn phí)
Cho phản ứng hóa học: CH3COOH + C2H5OH ⇔H2SO4đ, to CH3COOC2H5 + H2O Phản ứng trên thuộc A. Phản ứng thế. B. Phản ứng cộng. C. Phản ứng cracking. D. Phản ứng tách.
Có các phát biểu sau đây : 1. C2H5OH và C6H5OH đều phản ứng dễ dàng với HBr (Miễn phí)
Có các phát biểu sau đây : 1. C2H5OH và C6H5OH đều phản ứng dễ dàng với HBr. 2. C2H5OH có tính axit yếu hơn C6H5OH. 3. C2H5ONa và C6H5ONa phản ứng hoàn toàn với nước cho ra trở lại C2H5OH và C6H5OH. Chọn phát biểu sai: A. Chỉ có 1 B. Chỉ có 2 C. Chỉ có 3 D. 1 và 3
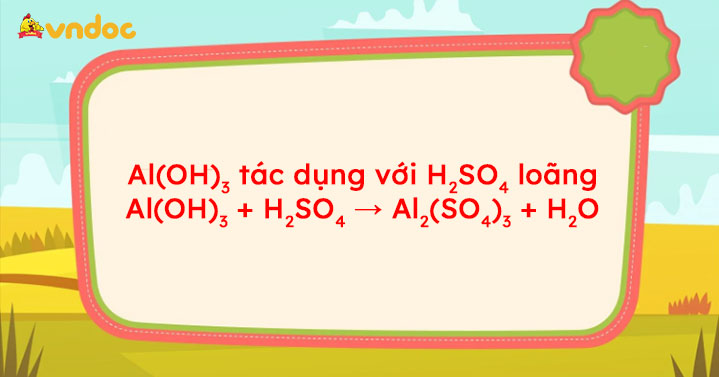
Al(OH)3 + H2SO4 → Al2(SO4)3 + H2O
Al(OH)3 H2SO4: Al(OH)3 + H2SO4 → Al2(SO4)3 + H2O được biên soạn là phương trình phản ứng giữa Al(OH)3 và H2SO4 loãng. Mời các bạn tham khảo.
Zn(NO3)2 + NH3(aq) = Zn(NH3)2 + NO3 - Balanced chemical equation, limiting reagent and stoichiometry
Balance Chemical Equation - Online Balancer
Acid chloric
Acid chloric có công thức là HClO3, là một acid có oxy của chlor. Là acid là một trong những acid mạnh (pKa ≈ −2.7), chỉ tồn tại ở dạng dung dịch. Acid chloric có tính oxy hóa mạnh; tác dụng với lưu huỳnh, phosphor, arsenic, khí lưu huỳnh dioxide. Giấy, bông bốc cháy ngay khi tiếp xúc với dung dịch HClO3 40%. Trong nước, nó mạnh tương đương với acid hydrochloric. Muối quan trọng nhất của nó là kali chlorat (KClO3). Acid chloric rất độc.
Fe2O3 + HI → H2O + I2 + FeI2 | Fe2O3 ra FeI2 | HI ra I2.
Fe2O3 + HI → H2O + I2 + FeI2 | Fe2O3 ra FeI2 | HI ra I2 - Hướng dẫn cân bằng phản ứng hóa học của tất cả phương trình hóa học thường gặp giúp bạn học tốt môn Hóa.
Natri biphosphat
Natri biphosphat (công thức hóa học: Na2HPO4) là muối natri của acid phosphoric. Nó là bột trắng có tính hút ẩm cao và tan được trong nước.[1] Vì thế nó được dùng trong thương mại như một phụ gia chống đông cục trong các sản phẩm bột. Nó có thể được tìm thấy về mặt thương mại ở cả dạng khan và hiđrat hoá.[2] Độ pH của dung dịch này vào khoảng 8,0 đến 11,0.
Aceton
Aceton (bắt nguồn từ từ tiếng Pháp acétone /asetɔn/),[1] còn được viết là a-xê-tôn,[1] là hợp chất hữu cơ, có công thức là (CH3)2CO. Aceton là một chất lỏng dễ cháy, không màu và là dạng keton đơn giản nhất. Aceton tan trong nước, dễ bay hơi và là dung môi chủ yếu dùng để làm sạch trong phòng thí nghiệm, đồng thời là một chất dùng để tổng hợp các chất hữu cơ và còn được sử dụng trong các thành phần hoạt chất của sơn móng tay. 6,7 triệu tấn aceton được sản xuất trên toàn thế giới trong năm 2010, chủ yếu sử dụng làm dung môi và sản xuất methyl metacrylat và bisphenol. Aceton được sản xuất và thải ra trong cơ thể người thông qua quá trình trao đổi chất và thường có trong máu và nước tiểu. Thử nghiệm độc tính sinh sản cho thấy rằng nó có tiềm năng thấp gây ra vấn đề sinh sản. Phụ nữ mang thai và cho con bú, trẻ em và những người mắc bệnh tiểu đường tiết nhiều aceton hơn những người khác. Đồng thời, khẩu phần ăn nhiều chứa nhiều keton làm tăng hàm lượng aceton, giúp trẻ sơ sinh và trẻ nhỏ giảm những cơn động kinh nếu mắc bệnh động kinh đề kháng.
Sắc ký là gì? Cách sử dụng sắc ký cột trong thí nghiệm
Sắc ký dựa trên khái niệm ...